Die Vorstellung eines Impfstoffs, der Krebs bekämpft, war lange Zukunftsmusik. Doch dank der mRNA-Technologie, die durch die COVID-19-Impfstoffe weltweite Bekanntheit erlangte, rückt diese Vision immer näher. Dieser Artikel beleuchtet den aktuellen Stand der Forschung, die vielversprechenden Fortschritte, aber auch die noch bestehenden Herausforderungen auf dem Gebiet der mRNA-Krebs-Impfstoffe. Wir erklären die Funktionsweise dieser innovativen Technologie, analysieren Ergebnisse aktueller Studien und diskutieren die ethischen Implikationen dieser vielversprechenden Therapieform.
Die mRNA-Revolution im Kampf gegen Krebs: Ein personalisierter Ansatz
Stellen Sie sich vor: Ihr Immunsystem wird dazu angeregt, Ihre Krebszellen gezielt zu eliminieren. Dies ist das Prinzip hinter mRNA-Krebs-Impfstoffen. Im Gegensatz zu traditionellen Impfstoffen, die abgeschwächte Krankheitserreger verwenden, liefern mRNA-Impfstoffe lediglich den Bauplan (die mRNA) für spezifische Krebs-Proteine – die sogenannten Neoantigene (zelluläre Strukturen, die vom Immunsystem als fremd erkannt werden). Der Körper "liest" diesen Bauplan, produziert die Proteine und das Immunsystem lernt, diese als Feinde zu bekämpfen. Der entscheidende Vorteil: Dieser Bauplan kann individuell an den jeweiligen Tumor angepasst werden – eine personalisierte Krebstherapie. "Die mRNA-Technologie ermöglicht eine unvorstellbare Präzision", erklärt Dr. Eva Schmidt, Onkologin am Universitätsklinikum Hamburg-Eppendorf. "Wir können den Impfstoff exakt auf die individuellen Merkmale des Tumors abstimmen."
Erfolge, Rückschläge und offene Fragen: Ein Blick auf aktuelle Studien
Erste klinische Studien zeigen vielversprechende Ergebnisse, insbesondere in Kombination mit anderen Krebstherapien wie Checkpoint-Inhibitoren. Diese verstärken die Immunantwort zusätzlich. Doch die Datenlage ist noch begrenzt. Langzeitstudien fehlen, um die Langzeitwirkung abschätzen zu können. Die Frage, ob mRNA-Impfstoffe auch als Monotherapie (alleinige Therapie) effektiv sind, bleibt offen. "Wir sehen vielversprechende Ansätze, aber wir befinden uns noch in einem frühen Stadium der Forschung", betont Prof. Dr. Markus Meier, Immunologe an der Ludwig-Maximilians-Universität München. "Langzeitdaten und groß angelegte Studien sind unerlässlich, um den tatsächlichen klinischen Nutzen zu validieren." Es wird erwartet, dass die ersten Zulassungen, wahrscheinlich für bestimmte Hautkrebsarten wie Melanome, erst in einigen Jahren (voraussichtlich ab 2025) erfolgen.
Personalisierung: Die größte Herausforderung und Chance zugleich
Die Personalisierung ist sowohl der große Vorteil als auch die größte Schwierigkeit. Die Herstellung eines individuellen Impfstoffs ist aufwendig und teuer. Die Entschlüsselung des Tumor-Bauplans und die Impfstoffproduktion benötigen Zeit und Ressourcen. Die Schwierigkeit liegt auch darin, geeignete Angriffspunkte zu finden. Tumorzellen unterscheiden sich oft nur geringfügig von gesunden Zellen. Daher ist die Entwicklung von Impfstoffen, die ausschließlich Krebszellen angreifen und gesunde Zellen verschonen, eine immense Herausforderung.
Der Einfluss der COVID-19-Impfstoffe: Ein komplexes Thema
Die COVID-19-Pandemie hat der mRNA-Technologie einen enormen Schub verliehen. Die schnelle Entwicklung und der Erfolg der COVID-19-Impfstoffe haben das Interesse an mRNA-basierten Therapien, auch im Krebsbereich, deutlich gesteigert. Die Frage nach einem möglichen Zusammenhang zwischen COVID-19-mRNA-Impfstoffen und der Krebsentstehung wird kontrovers diskutiert. Groß angelegte Studien zeigen bislang keine Hinweise auf eine erhöhte Krebsinzidenz. Jedoch müssen die Ergebnisse immer im Kontext der Methodik und Limitationen der jeweiligen Studien betrachtet werden.
Die Zukunft der mRNA-Krebstherapie: Vielversprechende Perspektiven
Die Forschung schreitet rasant voran. Wissenschaftler arbeiten an neuen Kombinationstherapien und der Optimierung der Impfstoffproduktion, um den Prozess effizienter und kostengünstiger zu gestalten. Ein wichtiges Ziel ist die Entwicklung prädiktiver Biomarker, um frühzeitig vorherzusagen, wer von der Therapie profitieren wird. Dies würde die Behandlung individualisieren und unnötige Therapien vermeiden. "Wir sind zuversichtlich, dass mRNA-Impfstoffe einen bedeutenden Beitrag zur Krebstherapie leisten können", sagt Dr. Schmidt. "Die Technologie hat enormes Potenzial, die Behandlung zu revolutionieren."
Wie funktionieren personalisierte mRNA-Krebstherapien in der Praxis? – Ein detaillierter Blick
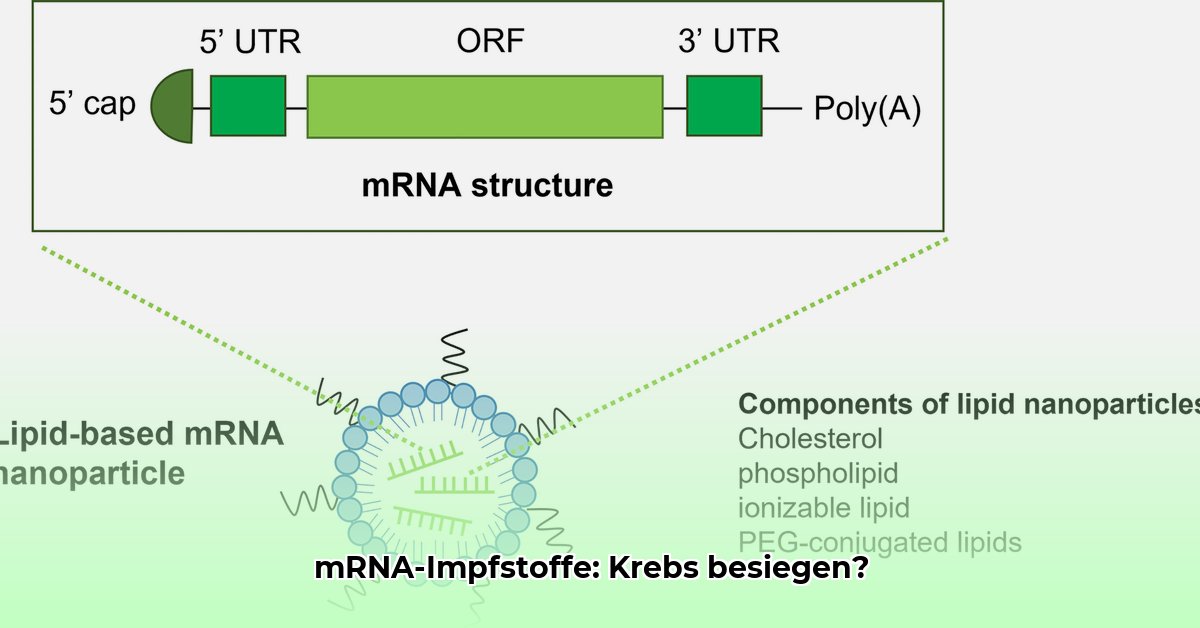
Der Prozess beginnt mit einer Biopsie, um Tumorzellen zu gewinnen. Die DNA dieser Zellen wird sequenziert, um die individuellen Neoantigene zu identifizieren. Diese Informationen dienen der Synthese personalisierter mRNA-Moleküle, die den genetischen Code für diese Neoantigene enthalten. Die mRNA wird in Lipid-Nanopartikeln verpackt und dem Patienten injiziert. Die Zellen des Patienten produzieren dann die Neoantigene, die vom Immunsystem erkannt und angegriffen werden. Spezialisierte Immunzellen (T-Zellen) lernen die Neoantigene zu identifizieren und zerstören Krebszellen mit diesen Merkmalen.
Herausforderungen: Die Wirksamkeit hängt vom Tumorstadium und der -größe ab. Kombinationstherapien werden erforscht, um die Effektivität zu steigern. Langzeitstudien sind notwendig, um die dauerhafte Wirksamkeit und mögliche Nebenwirkungen besser zu verstehen. Die Kosten und die Verfügbarkeit von ausreichend Tumormaterial stellen ebenfalls Limitierungen dar.
Zukünftige Entwicklungen und Ausblick
Die Forschung konzentriert sich auf die Verbesserung der mRNA-Stabilität, effizientere Verabreichungsmethoden und die Kombination mit anderen Behandlungsansätzen. Die Identifizierung spezifischerer Neoantigene und ein besseres Verständnis der Interaktionen zwischen Immunsystem und Tumor sind essentiell für zukünftige Erfolge. Die Überwindung der bestehenden Herausforderungen wird die breite klinische Anwendung dieser Technologie ermöglichen und das Leben vieler Krebspatienten verbessern. Die Entwicklung von mRNA-Impfstoffen gegen Krebs ist ein vielversprechender, aber auch langwieriger Prozess, der kontinuierliche Forschung und die Zusammenarbeit aller Beteiligten erfordert. Die Zukunft der Krebstherapie könnte durch diese Technologie grundlegend verändert werden.